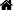在去除不需要的组织后,使用无菌的解剖刀和剪子把剩余的组织切成3~4 mm小片,通过悬浮在无钙镁的平衡盐溶液中清洗组织碎片。让组织碎片沉淀,去除上清液。重复清洗2到3次。将盛有组织碎片的容器置于冰上,去除残留的上清液。加入0.25%溶解在无钙镁的平衡盐溶液中的胰蛋白酶(100 mg组织加入1ml 胰蛋白酶)。在4℃孵育6到18小时,使几乎没有胰蛋白酶活性的酶尽可能渗透进去。
移弃组织碎片中的胰蛋白酶,在37℃孵育包含残留胰蛋白酶的组织碎片20到30分钟。在组织碎片加入热的*培养基,用移液管轻轻地分散组织。如果使用无血清培养基,要加入大豆胰蛋白酶抑制剂。通过无菌不锈钢丝网(100~200 mm)过滤,分散所有剩余组织。计数和接种细胞,进行培养。
用无菌解剖刀和剪子把剩余组织切成3~4 mm小片,用Hanks'平衡液(HBSS)清洗组织碎片几次。加入胶原酶(50~200单位/ml,溶解在HBSS中),在37℃孵育4到18小时。加入3mM CaCl2增加解离效率。
通过无菌不锈钢丝网或尼龙网过滤细胞悬液,以分离分散细胞、组织碎片和较大的碎片。如果需要进一步的解聚,在碎片中加入新鲜的胶原酶。通过离心在HBSS中清洗悬液几次。再一次在培养基中悬浮细胞,计数和接种细胞,进行培养。
用无菌解剖刀和剪子把剩余组织切成3~4 mm小片,用不含钙镁的平衡盐溶液清洗组织碎片几次。加入Dispase(0.6~2.4单位/ml 溶解在无钙镁的平衡盐溶液),在37℃孵育20分钟到几个小时。
通过无菌不锈钢丝网或尼龙网过滤细胞悬液,以分离分散细胞、组织碎片和较大的碎片。如果需要进一步的解聚,在碎片中加入新鲜的Dispase。通过离心在平衡盐溶液中清洗悬液几次。再一次在培养基中悬浮细胞,计数和接种细胞,进行培养。
5.对于无血清培养基,加入大豆胰蛋白酶抑制剂。通常使用1∶1(v∶v)0.25 mg/ml胰蛋白酶抑制剂到胰蛋白酶中将抑制胰蛋白酶活性。
以上是有关原代细胞纯化方法有哪些,希望可以帮助到大家。上海酶联生物以解决您的问题为己任,不断完善自身,提高企业文化,以便更好的服务于科研事业,欢迎您的咨询来电。