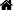盲肠结扎穿孔以及电针刺激
1. SD大鼠适应性饲养一周
2. 水合氯醛麻醉,然后打开腹部,对盲肠用生锈的注射器针头刺穿
3. 术后缝合,观察动物状态,并对电针组实验动物进行电针治疗
4. 在6h、12h分别处死部分动物取血
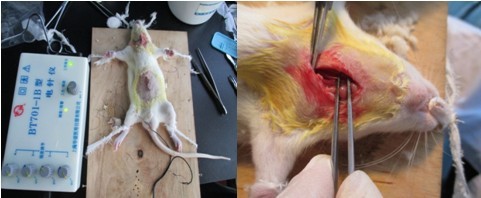
肿瘤模型(皮下种植结肠癌/肝癌/肺癌模型)
1. 购买4~6周的裸鼠,适应性饲养一周
2. 前肢腋下部位附近皮下种植结肠癌细胞,浓度1X107个/100ul
3. 注意无菌,然后饲养观察
4. 称重和实验观察和记录
5. 一般实验需要4周左右
大鼠心梗模型
1. 购买4-6周的大鼠,适应性饲养一周
2. 进行大鼠冠脉结扎,于末次给药后1h,在戊巴比妥钠腹腔麻醉下仰位固定于手术台,自左侧3-4肋间开胸,暴露心脏,于肺 动脉圆锥及左心房间找出冠脉左前降支,立即结扎冠脉,将心脏送回胸腔,并挤出胸腔内血液和气体,迅速关闭胸腔,开胸时间不超过30s。术后5天连续注射青霉素钠
3. 观察开胸后、缝针后、结扎后、关胸后心电图的变化
4. 合格后的大鼠在4周及6周后复查心电图

自体静脉移植
1. 选新西兰大耳兔,戊巴比妥钠按照体重麻醉
2. 切开颈部皮肤,钝性分离皮下组织;选取大小和直径同要移植部位的血管相同的静脉血管,先结扎该静脉的两端
3. 剪下该静脉,用灭菌生理盐水冲洗干净,备用
4. 将要移植部位的动脉血管,同周围组织分离,两端用动脉夹夹闭,然后剪下,把断端清洗干净;把前面的静脉缝合到该动脉断端。先稍微放开远心端的动脉夹,检查是否有渗血,确认无渗血后,同样 方法检查另外一端
5. 分层缝合,在关闭皮肤前,进行严格清洁和抗菌处理,然后缝合皮肤
6. 术后两周内静脉注射适量的肝素抗凝,随时观察实验动物的状态,及时处理;根据客户自己确定实验周期,准备动物和实验器材至少需要一周
贴剂动物体外实验
1. 实验分组及处理
2. 用药24h后取下,用温水洗脱
3. 分别于1h,24h,48h,72h肉眼观察局部有无红斑和水肿。然后连续用药7d,每天贴敷时间为12h,观察停药1h,24h,48h,72h后局部红斑、水肿情况,以及是否有色素沉着、出血点、皮肤粗糙或皮肤菲薄等情况,记录发生和消退时间
皮肤急性毒性试验
1. 实验分组及处理
2. 用药24h后取下,用温水洗脱
3. 分别于1h,24h,48h,72h至第7天,每天观察并记录动物的体重、皮毛光泽、饮食、眼和粘膜的变化,呼吸中枢、神经系统、四肢活动和死亡情况
4. 并于7天后处死大鼠,解剖观察其心、肝、肺、肾、卵巢、子宫等脏器有无异常变化,详细记录任何组织或器官出现的体积、颜色、质地的改变
5. 主要脏器称重,计算脏器指数
皮肤过敏试验
1. 实验分组及处理
2. 脱毛24h后,取痛经巴布贴贴敷在SD大鼠脱毛区,并以无刺激胶布固定,持续6h,第7天和第14天以同样方法重复一次
3. 于末次给痛经巴布贴巴布剂致敏后14d,将痛经巴布贴贴敷于SD大鼠脱毛区,赋形剂贴对照组与阳性对照组方法同上
4. 6h后去掉受试药物,即刻观察,并于24h,48h,72h再观察有无过敏反应,按表一记录个时间过敏反应分值,同时注意观察SD大鼠是否有哮喘、站立不稳或休克等严重的全身性过敏反应,计算致敏发生率
药效学实验
1. 实验分组及处理
2. 采用戊酸雌二醇+催产素引起大鼠子宫收缩为痛经模型。大鼠灌胃0.8mg/只/天(第1天和第10天),其它时间0.4mg/只/天,连续15天,第15天腹腔注射催产素2u/kg
3. 一般行为观察:精神状态、活动度、体重、食量、死亡率等
4. 扭体反应发生率观察:注射催产素后观察30min扭体反应发生率
5. 疗效观察:各组模型大鼠子宫、卵巢精确称重,计算子宫、卵巢指数
6. 观察对模型大鼠血液流变学的影响
IBD模型
1. 造模前 1d 禁食 24h 不禁水称重后,3%的戊巴比妥腹腔注射麻醉(或乙醚) 5%(W/V)的2,4,6-三硝基苯磺酸 (TNBS) 按 100mg/kg-150mg/kg(约等于TNBS 原液 0.4mL-0.6 mL,相当于 200 g 大鼠 20 mg-30 mg )
2. 分别加入乙醇,体位为头朝下,用聚丙烯管插入肛门上段4cm 注射器注入
3. 再倒立1-5min左右,以防药液溢出,每隔10d重复灌肠4次后可制成病鼠模型
4. 采血前观察SD大白鼠的情况,记录大鼠外观体征、行为活动、粪便的情况,记录死亡情况,每天称重
MTD实验
1. 动物称重并标记
2. 计算相应给药体积:按需计算每只动物的给药量,分为高中低3个梯度,并作记录
3. 给药操作
4. 给药后观察:在给药时记录给药时间。连续观察至少14天,观察一般指标(如动物外观、行为、对刺激的反应、分泌物、排泄物等)、动物死亡情况(死亡时间、濒死前反应等)、动物体重变化。记录所有的死亡情况、出现的症状,以及症状起始的时间、严重程度、持续时间等
肾脏缺血再灌注
1. 购买200g的SD大鼠,饲养一周,分组
2. 根据体重注射相应剂量的水合氯醛,麻醉后进行手术
3. 打开腹腔,钝性分离肾动脉,然后用动脉夹夹闭肾脏动脉30-45min,根据实验者的设计执行
4. 然后去除动脉夹,肾脏再次流入动脉血,肾脏由紫黑重新变为鲜红色
5. 然后根据实验要求取材
成年营养性肥胖大鼠模型
1. 购买体重200g的雄性SD大鼠
2. 方法 :用高脂 高糖饲料喂养成年大鼠四至八周
3. 观察大鼠体重及Lee’s指数、腹腔内脂肪重量及脂肪系数、葡萄糖耐量、血脂、血糖及血胰岛素水平 ,并算出胰岛素敏感性指数等
转基因小鼠筛选——鼠尾提取基因组DNA方法
1. 小鼠分笼后打耳标,剪取小鼠尾尖3mm-5mm左右于1.5mL 离心管中,标记耳标号
2. 配置消化液(SSTE),每管加入消化液0.5mL,蛋白酶K 1-5 μL, 55℃,3-5h,或放置过夜。(最长可放置3天)
3. 加1倍体积(0.5mL)PCI(下层液体),上下颠倒10余次。(PCI可分装出一些现用,以免操作不慎污染)
4. 室温15000rpm离心,10min
5. 取上清约0.4mL入新管,依次标号,加入异丙醇0.4mL ,4℃,15000rpm离心,5min
6. 弃上清,滤纸吸干,加入70%乙醇0.5mL,将管底沉淀弹起,上下颠倒几次,洗涤
7. 4℃,15000rpm离心,5-7min
8. 弃上清,瞬时离心,用枪吸干剩余液体,后经空气干燥5-10min
9. 加入1*TE 60-170μL一般加100μL,振荡30min溶解,于4℃冰箱保存