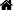细胞简介
施万细胞的胞核呈长卵圆形,其长轴与轴突平行,核周有少量胞质。由于施万细胞包在轴突的外面,故又称神经膜细胞(neurilemmalcell),它的外面包有一层基膜。施万细胞外面的一层胞膜与基膜一起往往又称神经膜(neurilem m a),光镜下可见此膜。在有髓神经纤维发生中,伴随轴突一起生长的施万细胞表面凹陷成一纵沟,轴突位于纵沟内,沟缘的胞膜相贴形成轴突系膜(m esaxon)。
轴突系膜不断伸长并反复包卷轴突,把胞质挤至细胞的内、外边缘及两端(即靠近郎氏结处),从而形成许多同心圆的螺旋膜板层,即为髓鞘。故髓鞘乃成自施万细胞的胞膜,属施万细胞的一部分。施万细胞的胞质除见于细胞的外、内边缘和两端外,还见于髓鞘板层内的施-兰
方法简介
质量检测
培养信息
使用方法
客户收到细胞后,请按照以下方法进行操作
1. 取出T 25细胞培养瓶,用75% 酒精消毒瓶身,拆下封口膜,放入37℃、5% C O 2、饱和湿度的细胞培养箱中静置3-4h,以稳定细胞状态。
2. 贴壁细胞消化
1)吸出T25细胞培养瓶中的培养基,用PBS清洗细胞一次。
2)添加0. 25% 胰蛋白酶消化液1m L至T 25培养瓶中,轻微转动培养瓶至消化液覆盖整个培养瓶底后,吸出多余胰蛋白酶消化液,37℃温浴1min。倒置显微镜下观察,待细胞回缩变圆后,再加入5ml完全培养基终止消化。
3)用吸管轻轻吹打混匀,按传代比例接种T25培养瓶传代,然后补充新鲜的完全培养基至5m L,置于37℃、5% C O 2、饱和湿度的细胞培养箱中静置培养。
4)待细胞完全贴壁后,培养观察。之后按照换液频率更换新鲜的完全培养基。
3. 复苏操作说明
1. 准备好37度水浴锅,预热至37度。
2. 准备好T25培养瓶,加入10ml完全培养基(培养基量必须大于冻存液10倍体积)。
3. 取出干冰内冻存细胞管,用EP手套包裹冻存管(防止管内进水导致污染),迅速放于水浴锅内,于1min内融化完全。
4. 取出冻存管,酒精喷洒消毒后擦干,置于超净台内。
5. 吸取冻存管内细胞悬液,加入步骤2中准备好的T25培养瓶内,8字缓慢摇匀。
6. 培养瓶放于37度C O 2恒温培养箱内,静置培养24h,更换新鲜换培养基(注意贴壁细胞、悬浮细胞不同换液操作方法)。
4. 细胞实验
因原代细胞贴壁特殊性,贴壁的原代细胞在消化后转移至其他实验器皿(如玻璃爬片、培养板、共聚焦培养皿等)时,需要对实验器皿进行包被,以增强细胞贴壁性,避免细胞因没贴好影响实验。包被条件常选用鼠尾胶原Ⅰ(2-5μg/cm2) ,多聚赖氨酸PLL(0. 1m g/m l),明胶(0. 1% ),依据细胞种类而定。悬浮/半悬浮细胞无需包被。